
Το HPV εμβόλιο στη νέα εποχή πρόληψης του καρκίνου του τραχήλου της μήτρας.
Ο καρκίνος του τραχήλου της μήτρας είναι η 2η σε συχνότητα κακοήθεια της γυναίκας παγκοσμίως και υπάρχει σημαντική διαφορά ως προς τη επίπτωση μεταξύ των περισσότερο και λιγότερο ανεπτυγμένων χωρών. Σε ολόκληρο τον κόσμο εμφανίζονται κάθε χρόνο ~470.000 νέες περιπτώσεις καρκίνου του τραχήλου της μήτρας και ~230.000 γυναίκες πεθαίνουν ετησίως από την ασθένεια αυτή. Είναι η δεύτερη συχνότερη αιτία θανάτου γυναικών από καρκίνο στον κόσμο. Στην Ευρώπη ~30.000 γυναίκες εμφανίζουν κάθε χρόνο καρκίνο τραχήλου μήτρας και ~15.000 γυναίκες πεθαίνουν κάθε χρόνο από την νόσο αυτή (~100 στην Ελλάδα).
Αξίζει να σημειωθεί ότι η μεγάλη πλειοψηφία των σεξουαλικά ενεργών ατόμων έχει εκτεθεί στον ιό HPV. Πιο συγκεκριμένα, ο εκτιμώμενος επιπολασμός σε γυναίκες και άνδρες 15-49 χρόνων είναι 75%. Σύμφωνα, με αυτά τα δεδομένα 25% του σεξουαλικά ενεργού πληθυσμού δε θα παρουσιάσει καμία μόλυνση, 60% θα παρουσιάσει πρωταρχική μόλυνση , 10% υποκλινική λοίμωξη, 4% ανωμαλία στη δοκιμασία κατά Παπανικολάου και την κολποσκόπηση και 1% οξυτενή κονδυλώματα. Σε διάφορες επιδημιολογικές μελέτες επιβεβαιώθηκε η παρουσία του ιού στον καρκίνο του τραχήλου της μήτρας και στη μελέτη των Walboomers και συν. φάνηκε ότι το 99,7% των δειγμάτων καρκίνου τραχήλου της μήτρας περιείχε HPV. Στη συνέχεια οι Munoz και συν. υπολόγισαν ότι ο σχετικός κίνδυνος από τη σχέση του HPV με τον καρκίνο του τραχήλου της μήτρας ήταν μεταξύ 150 και 500. Αυτός ο σχετικός κίνδυνος αξίζει να συγκριθεί με αυτόν της σχέσης καπνίσματος σιγαρέττων και καρκίνου των πνευμόνων, ο οποίος είναι σημαντικά μικρότερος και υπολογίζεται μεταξύ 10 και 15. Επομένως, ο καρκίνος του τραχήλου της μήτρας είναι η πρώτη μορφή καρκίνου στον άνθρωπο για την οποία έχει ταυτοποιηθεί η απαραίτητη αιτία της.
Η πρώτη περιγραφή των κλινικών εκδηλώσεων της λοίμωξης από τον ιό των θηλωμάτων του ανθρώπου ήρθε από τον Ιπποκράτη, ο οποίος περιέγραψε τους ακροχόρδωνες του γεννητικού συστήματος και χρησιμοποίησε τον όρο κονδυλώματα. Από τότε, σημαντικοί σταθμοί μέχρι σήμερα υπήρξαν το 1907 όταν ο Ciufo αναγνώρισε την ιογενή αιτιολογία των θηλωμάτων του δέρματος, τo 1976 όταν ο καθηγητής Zur Hausen πρώτος διατύπωσε την υπόθεση ότι ο ιός μπορεί να έχει αιτιολογική σημασία στον καρκίνο του γεννητικού συστήματος, διαπίστωση για την οποία πρόσφατα τιμήθηκε και με το βραβείο Νομπέλ. Το 1983 επιβεβαιώθηκε η παρουσία του HPV 16 στον καρκίνο του τραχήλου της μήτρας από τον Durst και τον επόμενο χρόνο του HPV 18 από τον Boshart. Το μεγάλο βήμα προόδου, όμως, ήρθε τη δεκαετία του 1990 όταν ερευνητές από την Αυστραλία παρήγαγαν την πρωτεϊνη L1 από τύπους του ιού και ανακάλυψαν ότι οι πρωτεϊνες L1 συγκεντρώνονται από μόνες τους σχηματίζοντας σωματίδια που μοιάζουν με τον ιό (VLPs). Ακολούθησε η παρασκευή των VLPS από L1 και L2, το 1992.
Ο ιός HPV ανήκει στην οικογένεια των ανθρώπινων θηλωμάτων (Pappilomaviridae) και διακρίνεται σε περισσότερους από 200 διαφορετικούς γενοτύπους. Χαρακτηρίζεται από υψηλή διατήρηση της φυλογεννητικότητας και από κυκλικό γένωμα διπλής έλικας DNA (7000–8000 ζεύγη βάσεων). Το ιοσωμάτιο είναι εικοσαεδρικό και αποτελείται από 72 πενταμερή καψομερίδια που σχηματίζονται από την πρωτεϊνη L1. Το γονιδίωμα του ιού κωδικοποιεί: πρωτεϊνες πρώϊμες (Ε) και όψιμες (L), ενώ περιλαμβάνει και μη κωδικοποιούσα ρυθμιστική περιοχή (LCR). Οι πρωτείνες Ε ελέγχουν τη προσκόλληση και αντιγραφή του DNA του ιού, ενώ έχουν και τη δυνατότητα να τροποποιούν το κύκλο ζωής των κυττάρων που προσβάλλονται. Πιο συγκεκριμένα, οι πρωτείνες Ε6 & Ε7 είναι κυρίως υπεύθυνες για τη καρκινογένεση. Οι πρωτείνες L αποτελούν πρωτεϊνες του καψιδίου του ιού και εκφράζονται μόλις πριν από το σχηματισμό και την απελευθέρωση των ιών. Η L1 αποτελεί την κύρια δομική πρωτεϊνη που σχηματίζει τα πενταμερή καψομερίδια, που συγκεντρώνονται από μόνα τους σχηματίζοντας σωματίδια που μοιάζουν με τον ιό (VLPs), ενώ πιθανότατα παρέχει προστασία έναντι μελλοντικής έκθεσης σε ιό με ίδιο επίτοπο L1. Η L2 κρατά το DNA του ιού σταθερό στη θέση του.
Όπως αναφέραμε, υπάρχουν περισσότεροι από 200 τύποι που χαρακτηρίζονται σαν δερματικοί (40 τύποι) ή βλεννογόνιοι (60 τύποι) ανάλογα με το επιθήλιο που αρχικά προσβάλλουν. Οι βλεννογόνιοι ανάλογα με τη επιδημιολογική τους σχέση με τον καρκίνο του τραχήλου της μήτρας διακρίνονται σε χαμηλού και υψηλού κινδύνου. Οι χαμηλού κινδύνου σχετίζονται με low grade τραχηλικές βλάβες, γεννητικά κονδυλώματα και υποτροπιάζοντα αναπνευστικά θηλώματα, ενώ οι υψηλού κινδύνου με low ή high grade τραχηλικές βλάβες και πρωκτογεννητικούς καρκίνους. Έτσι, ως υψηλού κινδύνου χαρακτηρίζονται οι τύποι HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 και 82. Χαμηλού κινδύνου χαρακτηρίζονται οι τύποι HPV 6, 11, 40, 42, 43, 44, 54, 61,70, 72 και 81, οι οποίοι μπορεί να σχετίζονται με την εκδήλωση του πλακώδους καρκίνου λάρυγγα και του σπάνιου συνδρόμου Bushke-Löwenstein του αιδοίου, του πέους και του ορθού, αλλά όχι με την εκδήλωση του καρκίνου τραχήλου της μήτρας.
Όσον αφορά τη νεανική υποτροπιάζουσα αναπνευστική θηλωμάτωση, γνωρίζουμε ότι αποτελεί μία σχετικά σπάνια νόσο (συχνότητα: 4.3 ανά 100 000 στις ΗΠΑ). Εμφανίζεται σε ηλικία 3.8 – 5.5 ετών και μάλιστα σε διπλάσια συχνότητα στους άρρενες. Σχεδόν όλες οι περιπτώσεις προέρχονται από περιγεννητική μόλυνση. Υπεύθυνοι κυρίως είναι οι τύποι 6,11 και η μετάδοση γίνεται από τη μητέρα κατά τη δίοδο από το γεννητικό σωλήνα. Η κλινική συμπτωματολογία περιλαμβάνει συριγμό και δυσφορία, ενώ η ανάπτυξη των θηλωμάτων του λάρυγγα μπορεί να οδηγήσει σε μαζική απόφραξη των αναπνευστικών οδών. Η αντιμετώπιση μπορεί να είναι συντηρητική (Cidofovir και Interferon) ή χειρουργική με laser εκτομή υπό γενική αναισθησία.
Η μετάδοση του ιού γίνεται κυρίως μέσω επαφής των γεννητικών βλεννογόνων, περιγεννητικά και σπάνια με άλλο τρόπο (αντικείμενα, με τα χέρια). Η χρήση προφυλακτικού μειώνει τον κίνδυνο μόλυνσης δεν προστατεύει όμως απόλυτα, επειδή ο ΗPV μπορεί να μεταδοθεί και με τη δερματική επαφή στην περιοχή των γεννητικών οργάνων. Στη δοκιμασία Παπανικολάου, οι μικροσκοπικές εκδηλώσεις του αυξανόμενου αριθμού ανώμαλων κυττάρων και ο βαθμός ανωμαλίας των κυττάρων αυτών χρησιμοποιούνται για την εκτίμηση του κινδύνου για καρκίνο. Σε ένα Pap test μπορεί να αναγνωριστούν άτυπα πλακώδη κύτταρα ακαθόριστης αιτιολογίας και χαμηλού ή υψηλού βαθμού ενδοεπιθηλιακές αλλοιώσεις του πλακώδους επιθηλίου.
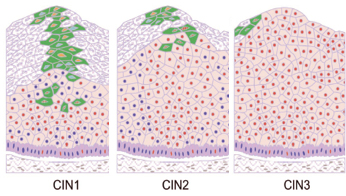
Στη βιοψία που ενδεχομένως θα χρειαστεί θα παρατηρηθούν ενδοεπιθηλιακές τραχηλικές νεοπλασίες, οι οποίες χαρακτηρίζονται σαν CIN Ι,ΙΙ ή ΙΙΙ ανάλογα με το ποσοστό του επιθηλίου που έχει προσβληθεί.
Στο CIN III λοιπόν βλέπουμε τα ανώμαλα κύτταρα να έχουν καταλάβει ολόκληρο το πάχος του επιθηλίου.
Τέσσερις είναι οι κύριες μέθοδοι για την ανίχνευση της μόλυνσης από HPV: η ανοσοϊστοχημεία, οι μέθοδοι υβριδισμού, η αλυσιδωτή αντίδραση πολυμεράσης (PCR) και η παραγωγή αντισωμάτων στον ορό μετά την μόλυνση από τον ιό.
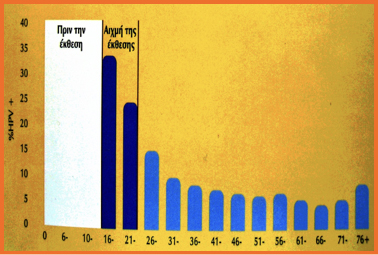
Η πρώτη επαφή με τον ιό συμβαίνει συνήθως νωρίς στην εφηβική ή στη νεαρή ενήλικη ζωή.
Για τον καρκίνο του τραχήλου της μήτρας διαπιστώθηκε με βάση τη μελέτη Seattle ότι συχνότερα ενοχοποιούνται οι τύποι 16 – 18 και λιγότερο συχνά άλλοι τύποι. Οι τύποι 16 και 18 προκαλούν το 70% των περιστατικών καρκίνου τραχήλου της μήτρας, ενώ οι τύποι 6 και 11 εμπλέκονται με το 90% των περιστατικών οξυτενών κονδυλωμάτων.
Η λοίμωξη από τον ιό HPV εμφανίζεται σχετικά σύντομα μετά την έναρξη των σεξουαλικών σχέσεων. Σε μια μελέτη που παρακολουθήθηκαν φοιτήτριες ενός κολλεγίου διαπιστώθηκε θετικό HPV DNA test στο 60%. Στις περισσότερες περιπτώσεις ο HPV εξαλείφεται από τον οργανισμό. Το 70% των νέων λοιμώξεων υποχωρούν αυτόματα τον πρώτο χρόνο (συνήθως στις περισσότερες περιπτώσεις τους πρώτους 6 μήνες) και το 91% σε διάστημα 2 ετών.
Οι χαμηλόβαθμες βλάβες αντιπροσωπεύουν την τοπική κυτταρολογική εκδήλωση της λοίμωξης. Οι υψηλόβαθμες αντιπροσωπεύουν την τοπική κυτταρολογική εκδήλωση του παθολογικού κυτταρικού πολλαπλασιασμού και της παθολογικής διαφοροποίησης, αποτέλεσμα της δράσης των πρώϊμων πρωτεϊνών του ιού. Η επιμένουσα λοίμωξη που ανιχνεύεται σε επανειλημμένες επισκέψεις και θέτει υποψία για εξέλιξη σε HGSIL, ενώ οι βλάβες υψηλού βαθμού έχουν την ικανότητα να εμμένουν και να εξελίσσονται σε διηθητικό καρκίνο.
Λοίμωξη συμβαίνει όταν ο ιός εισέλθει στα κύτταρα της βασικής στιβάδας του επιθηλίου. Παίρνει τότε υπό τον έλεγχο του τη διαδικασία ωρίμανσης των κυττάρων της βασικής στιβάδας και τη διαδικασία μετανάστευσης τους προς την επιφάνεια του επιθηλίου. Ο ιός χρησιμοποιεί τότε τους μηχανισμούς του κυττάρου και αντιγράφει το DNA του. Το ιϊκό DNA εσωκλείεται στη συνέχεια στο καψίδιο από τις πρωτεϊνες L1 & L2 και απελευθερώνεται με την Αποφολίδωση των τελικώς διαφοροποιημένων κερατινοποιημένων πλακωδών κυττάρων. Το χρονικό διάστημα που απαιτείται για τη διαδικασία αυτή είναι 3 εβδομάδες το νωρίτερο αλλά ποικίλλει από εβδομάδες μέχρι μήνες. Ανεξέλεγκτη έκφραση E6 και Ε7 αυξάνει τον κίνδυνο καρκινογέννεσης. Η έκφραση του E6 ελέγχεται από το E2. Μη ελεγχόμενη έκφραση του Ε6 οδηγεί σε μπλοκάρισμα της δράσης του p53, αντίσταση στην απόπτωση και αύξηση της χρωμοσωματικής αστάθειας. Μη ελεγχόμενη έκφραση του Ε7 οδηγεί σε παραγωγή πολλαπλών χρωμοσωμάτων, κυτταρική αθανατοποίηση και ογκογένεση.
Η αρχική λοίμωξη δεν σχετίζεται με κυτταρικό θάνατο ή φλεγμονή παρόλο που τελικά η πρωτεϊνη L1 προκαλεί ανοσιακή ανταπόκριση σε ποσοστό 46-59% των φυσικών λοιμώξεων. Η ύπαρξη της ανοσιακής αυτής απάντησης παρέχει προστασία έναντι μιας μελλοντικής έκθεσης σε ιό με τον ίδιο επίτοπο της L1.
Η ανοσιακή απάντηση όμως που στοχεύει στη πρωτεϊνη L1 δεν αποτελεί το μηχανισμό εξάλειψης μιας εγκατεστημένης λοίμωξης αφού η L1 εκφράζεται μόνο από το ιοσωμάτιο, στη φάση απελευθέρωσης του ιού από το επιθήλιο και μετά από αυτή. Η εξάλειψη μιας εγκατεστημένης λοίμωξης απαιτεί μία αντίδραση της κυτταρικής ανοσίας ενάντια στις πρώϊμες πρωτεϊνες που εκφράζονται κατά τη μεταναστευτική φάση του ιού.
Ετησίως, ξοδεύονται 4 εκατομμύρια δολλάρια για την αντιμετώπιση των επιπλοκών του HPV. Τα εμβόλια διακρίνονται σε προφυλακτικά που προσφέρουν προστασία από μελλοντικές μολύνσεις και σε θεραπευτικά για την αντιμετώπιση εγκατεστημένων αλλοιώσεων. Τα προφυλακτικά εμβόλια διακρίνονται στο τετραδύναμο (Gardasil) έναντι των ιών HPV 6, 11, 16, 18 και στο διδύναμο (Cervarix) έναντι των ιών HPV 16, 18. Ο μηχανισμός τους εξηγείται με τη χορήγηση ιόμορφων σωματιδίων (virus like particles) VLPs που εκφράζουν την L1 πρωτεϊνη. Τα VLPs έχουν υψηλή αντιγονικότητα. Έχουν τρισδιάστατη δομή όπως οι ζώντες ιοί. Στερούνται DNA του ιού και δεν μπορούν να προκαλέσουν λοίμωξη ούτε να πολλαπλασιαστούν, ενώ δεν είναι καρκινογόνα.
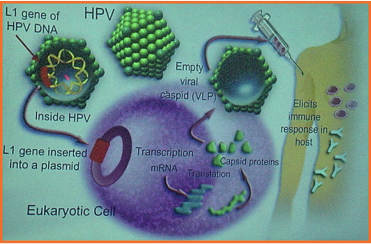
Το εμβόλιο μιμείται τον ιό χωρίς το γενετικό υλικό. Το αποτέλεσμα είναι η ενεργοποίηση της χυμικής ανοσίας με παραγωγή αντι-L1 αντισωμάτων, τα οποία δεν επιτρέπουν την είσοδο του ιού στα κύτταρα. To τετραδύναμο εμβόλιο στοχεύει στο 70% όλων των ΑΙS, CIN 2/3 και καρκίνων τραχήλου , περίπου στο 34% όλων των LGSIL/CIN1 και στο 90% όλων των γεννητικών κονδυλωμάτων.
Ο εμβολιασμός πραγματοποιείται σε τρεις δόσεις (0, στον 1 μήνα και στους 6 μήνες για το διδύναμο εμβόλιο και 0, στους 2 μήνες και στους 6 μήνες για το τετραδύναμο εμβόλιο). Το ΗΡV εμβόλιο αποδείχθηκε μέχρι σήμερα πολύ ασφαλές καi δεν εμφανίζει αυξημένη συχνότητα παρενεργειών σε σχέση με άλλα εμβόλια που γίνονται στiς ίδιες ηλικιακές ομάδες. Έχουν περιγραφεί ήπiα ενοχλήματα όπως: ήπιος πόνος, κνησμός, ερυθρότητα ή οίδημα στο σημείο του εμβολιασμού, δεκατiκή πυρετική κίνηση καi σπάνια πυρετός πάνω από 38°C. Ο εμβολιασμός είναι γενικά καλά αποδεκτός με πιο συχνά αναφερόμενη ανεπιθύμητη ενέργεια ,τον πόνο στο σημείο της ένεσης, ενώ η κεφαλαλγία είναι η πιο κοινή συστηματική αντίδραση. Συνιστάται η χορήγηση του εμβολίου να γίνεται με την γυναίκα να είναι καθιστή ή ξαπλωμένη, καθώς καi η παραμονή της επί 15/λεπτο στο χώρο του ιατρείου μετά τον εμβολιασμό. Μετά από την χορήγηση άνω των 2.000.000 δόσεων του εμβολίου στiς ΗΠΑ εμφανίστηκαν μόλις 3 περιπτώσεις του συνδρόμου παράλυσης Guillain-Barre, το οποίο, ανεξάρτητα από εμβολιασμό, εμφανίζεται ούτως ή άλλως στον γενικό πληθυσμό με μεγαλύτερη συχνότητα. Όσον αφορά την περίπτωση εγκυμοσύνης, συνιστάται η έναρξη του εμβολιασμού μετά την ολοκλήρωση της κύησης. Αν διαπιστωθεί εγκυμοσύνη μετά την έναρξη του εμβολιασμού, οι υπόλοιπες δόσεις καθυστερούν για μετά τον τοκετό, ενώ αν μία δόση χορηγηθεί κατά τη διάρκεια της κύησης δεν υπάρχει ένδειξη επέμβασης. Το γεγονός όμως θα πρέπει να αναφερθεί. Επίσης, αξίζει να σημειωθεί ότι ο εμβολιασμός δεν αντενδείκνυται κατά το θηλασμό.
Εδειξε 100% αποτελεσματικότητα ενάντι στη συνδυασμένη συχνότητα εμφάνισης των HPV 16/18 που σχετίζονται με CIN 2/3 και AIS, ενώ αναμένεται να μειώσει τον κίνδυνο εμφάνισης του καρκίνου του τραχήλου της μήτρας. Ο πλέον σωστός χρόνος εμβολιασμού είναι πριν την έναρξη των σεξουαλικών επαφών, ώστε να μπορέσουν να αποκομίσουν τη μέγιστη δυνατή προστασία. Στο στάδιο αυτό της ζωής τους, το εμβόλιο μπορεί να προφυλάξει σχεδόν μέχρι 100% από τους 4 συγκεκριμένους τύπους του ιού, ενώ σε μεγαλύτερες ηλικίες η αποτελεσματικότητά του είναι μικρότερη, αφού η γυναίκα ενδέχεται να έχει ήδη μολυνθεί από τον ιό. Η ιδανικότερη ηλικία θεωρείται ότι είναι μεταξύ 11 και 12 ετών, οπότε υπάρχει άριστη ανοσογονικότητα, δηλαδή ικανοποιητική δημιουργία αντισωμάτων. Ενώ ο εμβολιασμός μπορεί να αρχίσει σε ηλικίες 9 ετών, οι περισσότερες νέες γυναίκες μπορούν να επωφεληθούν( γυναίκες 16 – 26 ετών με ≤5 συντρόφους) από τον εμβολιασμό.
Η Ελληνική Μαιευτική Γυναικολογική Εταιρία σε συνεργασία με την Ελληνική Εταιρία Κολποσκόπησης και Παθολογίας του Τραχήλου, την Ελληνική Εταιρία Γυναικολογικής Ογκολογίας και την Ελληνική Εταιρία για την Πρόληψη και Θεραπεία του Ιού των Ανθρωπίνων Θηλωμάτων (HPV) εξέδωσε τον Ιούνιο του 2007 ‘Oδηγίες για τη χρήση του HPV εμβολίου’. Σύμφωνα με τις οδηγίες:
- Προτείνεται η ένταξη του εμβολιασμού των κοριτσιών ηλικίας 12-13 ετών στο Εθνικό Πρόγραμμα Εμβολιασμού.
- Οι γυναίκες ηλικίας 15 – 26 μπορούν να εμβολιαστούν είτε γιατί δεν έχουν αρχίσει τη σεξουαλική τους δραστηριότητα είτε δεν είναι απαραίτητο να έχουν μολυνθεί από τον ιό HPV ή ακόμα και αν έχουν μολυνθεί, είναι σπάνιο να έχουν μολυνθεί από όλους τους τύπους του HPV από τους οποίους προστατεύει το εμβόλιο.
Τον Ιανουάριο 2008, ο Υπουργός Υγείας ανακοίνωσε ότι το εμβόλιο κατά του καρκίνου του Τραχήλου της Μήτρας έχει εντάχθηκε στο Εθνικό Πρόγραμμα Εμβολιασμών.
Μια γυναίκα που έχει ήδη σεξουαλικές επαφές μπορεί να κάνει το εμβόλιο, αλλά έχει αυξημένες πιθανότητες να έχει έρθει ήδη σε επαφή με κάποιο τύπο του ιού. Η προστασία που παρέχει σε αυτήν την περίπτωση το εμβόλιο είναι πιθανόν ελαττωμένη. Έτσι, π.χ., εάν έχει ήδη προσβληθεί από έναν από τους 4 τύπους του ιού που καλύπτει το εμβόλιο, αυτό θα την προφυλάξει από τους άλλους 3 τύπους, αλλά όχι από τον ιό με τον οποίο έχει έρθει ήδη σε επαφή. Δηλαδή, δεν αποκλείεται στο μέλλον να εμφανίσει κάποια βλάβη (κονδύλωμα ή προ-καρκινική αλλοίωση ή και καρκίνο στον τράχηλο) που θα οφείλεται στο στέλεχος του ιού με το οποίο είχε έρθει παλαιότερα σε επαφή. Μια γυναίκα μπορεί να ελέγξει εάν έχει προσβληθεί από τον HPV προτού κάνει το εμβόλιο με το ΗΡV-DΝΑ τεστ, μια εξέταση με διαδικασία λήψης παρόμοια με αυτήν του τεστ Παπανικολάου. Με αυτήν τη εξέταση μπορούμε να ελέγξουμε εάν η γυναίκα έχει αυτήν τη στιγμή λοίμωξη με κάποιον τύπο του HPV
Σύμφωνα με τις έρευνες που έχουν ανακοινωθεί, το εμβόλιο προστατεύει για τουλάχιστον 5 χρόνια. Αξίζει να σημειωθεί ότι δεν προτείνεται καμία αλλαγή όσον αφορά το screening των γυναικών που υποβλήθηκαν σε εμβολιασμό γιατί δεν καλύπτεται από το εμβόλιο το 30% των τραχηλικών καρκίνων που προκαλούνται από HPV (αν και αναφέρεται ότι ο εμβολιασμός προσφέρει προστασία και από τους ιούς HPV 31,45, 52 και 58) ή δεν μπορεί να αποκλεισθει η μόλυνση των εμβολιασθέντων από τύπους HPV που δεν περιλαμβάνονται στο εμβόλιο ή η μόλυνση των εμβολιασθέντων προ του εμβολιασμού. Επιπλέον, η απόφαση για εμβολιασμό δεν πρέπει να βασιστεί στο Pap test, το HPV DNA test ή το ορολογικό test για HPV.















